化学性质
中文名 氯化铵
外文名 ammonium chloride
别名 电盐、电气药粉、盐精、硇砂
化学式 NH4Cl
分子量 53.49
CAS登录号 12125-02-9
EINECS登录号 235-186-4
熔点 340 ℃
沸点 520 ℃
水溶性 易溶
密度 1.527 g/cm³
外观 白色
安全性描述 S22;S36;S26
危险性符号 R22;R36
危险性描述 Xn
UN危险货物编号 9085
性质
水溶液呈弱酸性,加热时酸性增强。对黑色金属和其它金属有腐蚀性,特别对铜腐蚀更大,对生铁无腐蚀作用。
该产品主要有两种生产工艺:一是用中国著名科学家侯德榜发明的侯氏制碱法,同时生产纯碱和氯化铵两种产品;二是生产碳酸钾等钾盐的副产品。氯化铵很容易结块,通常用添加防结块剂的方式来防止产品结块。
氯化铵在水中溶解度温度/℃ | 溶解度/g |
0 | 29.4 |
10 | 33.3 |
20 | 37.2 |
30 | 41.4 |
40 | 45.8 |
50 | 50.4 |
60 | 55.2 |
70 | 60.2 |
80 | 65.6 |
90 | 71.3 |
100 | 77.3 |
理化性质
化学式:NH4Cl
电子式:
相对分子质量:53.49

性状
无色晶体或白色颗粒性粉末,是一种强电解质,溶于水电离出铵根离子和氯离子,氨气和氯化氢化合生成氯化铵时会有白烟。无气味。味咸凉而微苦。吸湿性小,但在潮湿的阴雨天气也能吸潮结块。粉状氯化铵极易潮解,合格品尤甚,吸湿点一般在76%左右,当空气中相对湿度大于吸湿点时,氯化铵即产生吸潮现象,容易结块。能升华(实际上是氯化铵的分解和重新生成的过程)而无熔点。相对密度1.5274。折光率1.642。低毒,半数致死量(大鼠,经口)1650mg/kg。有刺激性。加热至350℃升华,沸点520℃。
易溶于水,微溶于乙醇,溶于液氨,不溶于丙酮和乙醚。盐酸和氯化钠能降低其在水中的溶解度,其水中溶解度在0℃时为29.4g,10℃为33.2g,20℃为37.2g,30℃为41.4g,40℃为45.8g,50℃为50.4g,60℃为55.3g,70℃为60.2g,80℃为65.6g,90℃为71.2g,100℃为77.3g)。加热至100℃时开始分解,337.8℃时可以完全分解为氨气和氯化氢气体,遇冷后又重新化合生成颗粒极小的氯化铵而呈现为白色浓烟,不易下沉,也极不易再溶解于水。
水溶液的pH:因为在水中电离出的铵根离子水解使溶液显酸性,常温下饱和氯化铵溶液PH值一般在5.6左右。25℃时,1%为5.5,3%为5.1,10%为5.0。氯化铵本身可以作为铋、锑的稳定试剂(提供氯离子进行配位,使用时将其化合物与氯化铵共溶于稀盐酸中)。
化学性质
化学性质 无色立方晶体或白色结晶。味咸凉而微苦。 易溶于水,溶于液氨,微溶于醇,不溶于丙酮和乙醚。
安全信息
危险性概述
对皮肤、粘膜有刺激性,可引起肝肾功能损害,诱发肝昏迷,造成氮质血症和代谢性酸中毒等。健康人应用50g 氯化铵可致重度中毒,有肝病、肾病、慢性心脏病的患者,5g即可引起严重中毒。口服中毒引起化学性胃炎,严重者由于血氨显著增高,诱发肝昏迷。严重中毒时造成肝、肾损害,出现代谢性酸中毒,同时支气管分泌物大量增加。职业性接触,可引起呼吸道粘膜的刺激和灼伤。慢性影响: 经常性接触氯化铵,可引起眼结膜及呼吸道粘膜慢性炎症。
不燃,具刺激性。
个人防护
呼吸系统防护:空气中粉尘浓度超标时,必须佩戴自吸过滤式防尘口罩。紧急事态抢救或撤离时,应该佩戴空气呼吸器。
眼睛防护:戴化学安全防护眼镜。
身体防护:穿防毒物渗透工作服。
手防护:戴橡胶手套。
其他防护:工作完毕,淋浴更衣。注意个人清洁卫生。产品设备要密闭,车间通风应良好。
急救措施
皮肤接触:脱去污染的衣着,用大量流动清水冲洗。
眼睛接触:提起眼睑,用流动清水或生理盐水冲洗。就医。
吸入:迅速脱离现场至空气新鲜处。保持呼吸道通畅。如呼吸困难应立即就医处治。
食入:饮足量温水,催吐。洗胃,导泄。就医。
消防措施
危险特性:未有特殊的燃烧爆炸特性。受高温分解产生有毒的腐蚀性烟气。
有害燃烧产物:氯化氢、氮氧化物。
灭火方法:消防人员必须穿全身防火防毒服,在上风向灭火。灭火时尽可能将容器从火场移至空旷处。
泄漏应急处理
应急处理:隔离泄漏污染区,立即切断泄漏源,将盛装容器讯速移出事故区域,远离热源,火源。应急处置人员应佩戴安全防护用品,事故处理完,应将处理用品用具,参与废料、事故现场,清洗废水等进行无害化处理酯达到环保要求。。建议应急处理人员戴防尘面具(全面罩),穿防毒服。避免扬尘,小心扫起,置于袋中转移至安全场所。若大量泄漏,用塑料布、帆布覆盖。收集回收或运至废物处理场所处置。
合成方法
用途
1.用作分析试剂,如配制氨-氯化铵缓冲溶液。用作电化学分析中的支持电解质。用作发射光谱分析用的电弧稳定剂。原子吸收光谱分析用的干扰抑制剂。
2.用于制造干电池和蓄电池。是制造其他铵盐的原料。用作染色助剂、电镀浴添加剂、金属焊接助熔剂。也用于镀锡和镀锌、鞣革、医药、制蜡烛、黏合剂、渗铬、精密铸造。
用作反刍动物的非蛋白饲料添加剂。在肉鸡日粮中添加1%的氯化铵,可提高日增重25%;在饮水中添加0.25%~0.3%的氯化铵,可提高日增重23%,并可减轻败血霉形体的感染。对控制动物尿结石有一定的作用。
3.在食品工业中用作酵母养料、面团调节剂。
4.用作脲醛树脂胶黏剂和三聚氰胺甲醛树脂胶黏剂的固化剂。
5.氯化铵用于氯化亚铁电镀铁的添加,可提高导电能力及硬度,并可减慢亚铁的氧化速度.



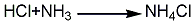
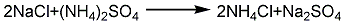
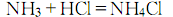 若溶液呈酸性则需添加少量氨水使溶液呈碱性后加热至沸,趁热过滤,滤液浓缩蒸发到有结晶薄膜止,冷却结晶 ( 必要时用冰水冷却) 、干燥,可得氯化铵试剂。若使用高纯盐酸、高纯氨水和电导水,可得到高纯氯化铵。6.一步热法 将制碱母液送至蒸发锅加热至沸腾(≥110℃)浓缩。待有NH4Cl结晶析出即停止加热,然后加BaCl2除SO2-4,加KMnO4除铁质。澄清一下即可趁热(≥100℃)保温过滤。大量的食盐结晶和其他水不溶物被滤掉,滤渣送化盐池回收食盐,滤液送结晶器进行冷却结晶。结晶的氯化铵送至离心机甩干,并用适量的水洗涤,以洗去晶间残余母液,然后干燥,包装。还可以用氯化氢和氨反应制取,或利用炼焦所得的氨气与氯化氢反应的气相合成法制取,或用硫酸铵与食盐作用的复分解法制得,以及联碱法的副产物。
若溶液呈酸性则需添加少量氨水使溶液呈碱性后加热至沸,趁热过滤,滤液浓缩蒸发到有结晶薄膜止,冷却结晶 ( 必要时用冰水冷却) 、干燥,可得氯化铵试剂。若使用高纯盐酸、高纯氨水和电导水,可得到高纯氯化铵。6.一步热法 将制碱母液送至蒸发锅加热至沸腾(≥110℃)浓缩。待有NH4Cl结晶析出即停止加热,然后加BaCl2除SO2-4,加KMnO4除铁质。澄清一下即可趁热(≥100℃)保温过滤。大量的食盐结晶和其他水不溶物被滤掉,滤渣送化盐池回收食盐,滤液送结晶器进行冷却结晶。结晶的氯化铵送至离心机甩干,并用适量的水洗涤,以洗去晶间残余母液,然后干燥,包装。还可以用氯化氢和氨反应制取,或利用炼焦所得的氨气与氯化氢反应的气相合成法制取,或用硫酸铵与食盐作用的复分解法制得,以及联碱法的副产物。

